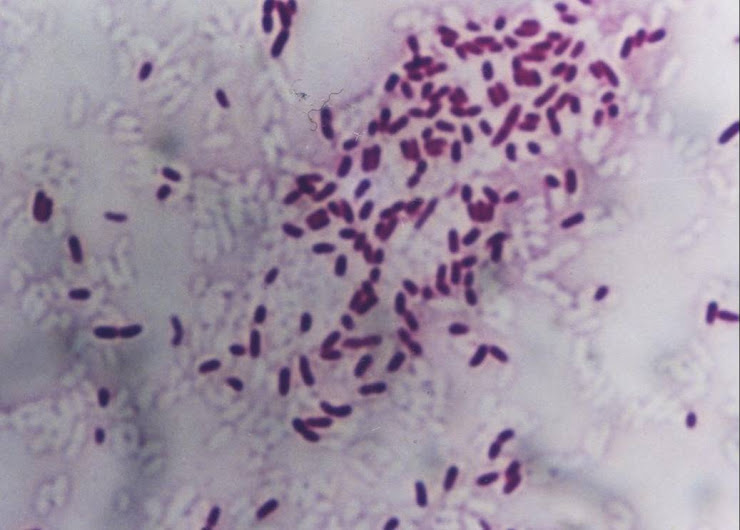
Estafilococo Meticilino Resistente, un Problema Actual en la Emergencia de Resistencia entre los Gram Positivos
Echevarria Zarate, Juan *; Iglesias Quilca, David **
*Profesor Asociado, Departamento de Medicina de la Facultad de Medicina Alberto Hurtado. Investigador Asociado del Instituto de Medicina Tropical Alexander von Humboldt de la Universidad Peruana Cayetano Heredia. Departamento de Enfermedades Transmisibles y Dermatológicas. Hospital Nacional Cayetano Heredia.
** Programa de Residencia en Infecciosas y Medicina Tropical . Dirección de Post-Grado. Facultad de Medicina Alberto Hurtado. Departamento de Enfermedades Transmisibles y Dermatológicas. Hospital Nacional Cayetano Heredia.
Las enfermedades infecciosas constituyen la primera causa de morbimortalidad a nivel mundial, en especial en países subdesarrollados como el nuestro, por ello el tratamiento adecuado y oportuno de las mismas, tendrá un impacto importante en los índices de salud. Lamentablemente uno de los grandes problemas que se enfrenta en la actualidad es la creciente emergencia de resistencia de los gérmenes a los antibióticos convencionales.
La susceptibilidad de los diversos gérmenes ha variado grandemente los últimos años. Cepas que habían sido consistentemente susceptibles para todos los agentes antimicrobianos por décadas, ahora han desarrollado resistencia a estas terapias clásicas, tienen la habilidad de desarrollar rápidamente resistencia a los antimicrobianos más nuevos (1).
Los microorganismos viven millones de años mas tiempo sobre la tierra que el ser humano. Para poder sobrevivir los seres humanos hemos desarrollado un equilibrio adecuado con la flora de microorganismos que cohabitan con nosotros; a este grupo de microorganismos se les conoce como flora interna y residen en las superficies corporales expuestas al medio ambiente (piel y mucosas), limitadas por la integridad de nuestras barreras de protección (tejidos externos, sistema inmunológico humoral y celular. En algunas circunstancias ese equilibrio se rompe, sea por la ruptura de las barreras de contención ó por una disminución de las defensas, lo que origina la invasión y diseminación bacteriana al interior del ser humano, originando la presencia de una infección y el riesgo consecuente de enfermedad.
Hasta hace menos de un siglo, la presencia de una enfermedad como neumonía era prácticamente sinónimo de sentencia a muerte, al igual que una simple infección de partes blandas. En este momento, por el contrario se puede hablar de éxito en la terapia de infecciones mucho más severas como meningitis y septicemia, y con mayor en infecciones menores, y esto es debido al desarrollo de agentes terapéuticos como los antibióticos.
Fleming descubrió la penicilina en 1928, y recién a partir de 1940 se le comenzó a administrar como indicación terapéutica para una serie de infecciones, entre ellas neumonía, sífilis e infección de partes blandas; pero lamentablemente casi a la par, ya que solo transcurrieron 6 años, para que el antibiótico pierda vigencia en el tratamiento de infecciones por Estafilococo, en virtud de que este microorganismo desarrolló una enzima, que por su acción se llamó Betalactamasa, que degrada la principal estructura química de la penicilina, el núcleo beta-lactámico (2).
Las bacterias pueden tener una resistencia natural o intrínseca a alguna(s) familias de antibióticos, la misma que ya este presente antes de que la bacteria se exponga al uso del agente terapéutico. Esta resistencia es dependiente de la variabilidad genética que sufre la bacteria en su evolución a través del tiempo. Este hecho ha podido ser comprobaba al exponer a antibióticos cepas de bacterias halladas en las profundidades de los glaciares en las regiones árticas de Canadá, con mas de 2,000 años de antigüedad, y que por tanto fueron 19 siglos precedentes al desarrollo de los antibióticos por el ser humano (3).
Por otro lado, la resistencia a un antibiótico puede ser adquirida por la bacteria. Esta se genera por mecanismos como pequeñas mutaciones (mutaciones puntifornes, a veces únicas), o grandes mutaciones (Transposición ó translocación de grandes cadenas) de su material genético. Otro mecanismo por el cual la bacteria puede adquirir resistencia es mediante la adquisición ó transmisión de genes de la resistencia intra ó inter- especies. Este intercambio de información de material genético usualmente extra-cromosómico se realiza mediante vehículos que trasladan el material de bacteria a bacteria, llamados integrones, bacteriófagos o transposones (4). Por ello una bacteria es capaz de adquirir la resistencia a un antibiótico sin necesidad de haber estado en contacto muchas veces con estos.
La bacteria puede ejercer diferentes mecanismos para su subsistencia y protección contra los antibióticos utilizan una serie de mecanismos llamados de Resistencia, que podemos resumir como sigue:
· Inactivación enzimatica del antibiótico, mecanismo en la que la bacteria genera una sustancia (enzima) que altera o destruye la estructura química de la molécula antibiótica (Ej. Betalactamasas para los antibióticos betalactamicos, aciltransferasas para los aminoglicosidos ó el cloranfenicol).
· Alteración de las barreras de permeabilidad, muy usado en bacterias gram negativas. Se describen dos mecanismos 1) Alterar los poros por los cuales penetra el antibiótico la membrana externa. 2) Eflujo activo: Se altera la producción de energía y se disminuye el ingreso del antibiótico y se promueve un mecanismo de expulsión activa del antimicrobiano.
· Alteración del sitio blanco, definiéndose sitio blanco como el lugar donde se une el antibiótico para ejercer su acción antimicrobiana. Los sitios blancos usualmente son proteínas de la membrana u otro componente de la estructura bacteriana que juega un rol en algún mecanismo que suele ser vital para la subsistencia o reproducción bacteriana. Ejemplo de esto es el proceso de crecimiento, respiración, elongación bacteriana, etc. La bacteria ejerce este mecanismo de resistencia modificando o cambiando estos sitios blanco, de forma tal que el antibiótico no pueda unirse, o ejercer acción sobre el PBP y por tanto no puede alterar este mecanismo del proceso de vida bacteriano.
La frecuencia y nivel de resistencia de bacteria a un antibiótico varía con relación a una serie de factores. La resistencia puede variar en el tiempo, además va a ser diferente en las diferentes áreas geográficas, dependiente de sí la bacteria reside en la comunidad ó en un centro de atención de salud, y dentro del mismo el nivel de resistencia va a variar dependiendo del nivel de complejidad de la Unidad Hospitalaria. Se ha determinado que existe una serie de factores de la práctica médica diaria:
· Frecuencia en el uso de antibióticos en el sistema.
· Uso racional de los mismos.
· La variación genética espontánea e inducida por la presión selectiva de los antibióticos sobre determinados gérmenes.
Un poco más de 60 años luego de la aparición de los antibióticos se describen serios problemas. En la actualidad se observa con frecuencia creciente, la presencia de infecciones por gérmenes multi-resistentes, causantes de afecciones que llevan a la muerte a pacientes, ante la incapacidad del médico de modificar el curso del proceso, por carencia de un agente terapéutico al que estos sean susceptibles.
En el ámbito comunitario se describe que un número importante de familias de antibióticos, entre las que se encuentra las sulfas, amino penicilinas, tetraciclinas, etc., están entrando en desuso para el manejo de afecciones frecuentes en la comunidad como lo son las infecciones urinarias, gastrointestinales y de vías respiratorias causadas por bacterias gram negativas, como las enterobacteriáceas, Salmonellas, Shigellas (5). Gérmenes que afectan las vías respiratorias, como Haemophilus influenzae, se describen en como Resistentes a las aminopencilinas en diferentes regiones geográficas. La resistencia de Neumococo a la penicilina se está globalizando, y tanto la frecuencia como el nivel de resistencia, van en incremento progresivo (6).
En los hospitales, son huéspedes susceptibles para adquirir infecciones por gérmenes nosocomiales tanto los pacientes que se internan como el personal que labora por bacterias gram negativas como Pseudomonas aeruginosa, Klebsiellas, han desarrollado Betalactamasas de espectro ampliado o cromosomiales, que inactivan las moléculas antibióticas más complejas (5) y por bacterias gram positivas como Enterococo ó Estafilococos Meticilino que tienen una incidencia creciente, casi exponencial en áreas críticas hospitalarias y son difíciles de tratar y controlar (7, 8).
El impacto de la resistencia bacteriana en la salud y en la economía de las personas, ó Instituciones de salud no ha sido correctamente determinado, pero se describe claramente que incrementa indicadores como mortalidad, morbilidad y costo hospitalario. Para el manejo de estas infecciones se consume de mayores recursos de salud y las cifras que se calculan se asume subestiman largamente los costos del manejo de este problema. Las cifras reportadas actualmente asumen que el gasto anual es un valor que se encuentra entre 100 millones a 30 billones de dólares (9,10).
Echevarria Zarate, Juan *; Iglesias Quilca, David **
*Profesor Asociado, Departamento de Medicina de la Facultad de Medicina Alberto Hurtado. Investigador Asociado del Instituto de Medicina Tropical Alexander von Humboldt de la Universidad Peruana Cayetano Heredia. Departamento de Enfermedades Transmisibles y Dermatológicas. Hospital Nacional Cayetano Heredia.
** Programa de Residencia en Infecciosas y Medicina Tropical . Dirección de Post-Grado. Facultad de Medicina Alberto Hurtado. Departamento de Enfermedades Transmisibles y Dermatológicas. Hospital Nacional Cayetano Heredia.
Las enfermedades infecciosas constituyen la primera causa de morbimortalidad a nivel mundial, en especial en países subdesarrollados como el nuestro, por ello el tratamiento adecuado y oportuno de las mismas, tendrá un impacto importante en los índices de salud. Lamentablemente uno de los grandes problemas que se enfrenta en la actualidad es la creciente emergencia de resistencia de los gérmenes a los antibióticos convencionales.
La susceptibilidad de los diversos gérmenes ha variado grandemente los últimos años. Cepas que habían sido consistentemente susceptibles para todos los agentes antimicrobianos por décadas, ahora han desarrollado resistencia a estas terapias clásicas, tienen la habilidad de desarrollar rápidamente resistencia a los antimicrobianos más nuevos (1).
Los microorganismos viven millones de años mas tiempo sobre la tierra que el ser humano. Para poder sobrevivir los seres humanos hemos desarrollado un equilibrio adecuado con la flora de microorganismos que cohabitan con nosotros; a este grupo de microorganismos se les conoce como flora interna y residen en las superficies corporales expuestas al medio ambiente (piel y mucosas), limitadas por la integridad de nuestras barreras de protección (tejidos externos, sistema inmunológico humoral y celular. En algunas circunstancias ese equilibrio se rompe, sea por la ruptura de las barreras de contención ó por una disminución de las defensas, lo que origina la invasión y diseminación bacteriana al interior del ser humano, originando la presencia de una infección y el riesgo consecuente de enfermedad.
Hasta hace menos de un siglo, la presencia de una enfermedad como neumonía era prácticamente sinónimo de sentencia a muerte, al igual que una simple infección de partes blandas. En este momento, por el contrario se puede hablar de éxito en la terapia de infecciones mucho más severas como meningitis y septicemia, y con mayor en infecciones menores, y esto es debido al desarrollo de agentes terapéuticos como los antibióticos.
Fleming descubrió la penicilina en 1928, y recién a partir de 1940 se le comenzó a administrar como indicación terapéutica para una serie de infecciones, entre ellas neumonía, sífilis e infección de partes blandas; pero lamentablemente casi a la par, ya que solo transcurrieron 6 años, para que el antibiótico pierda vigencia en el tratamiento de infecciones por Estafilococo, en virtud de que este microorganismo desarrolló una enzima, que por su acción se llamó Betalactamasa, que degrada la principal estructura química de la penicilina, el núcleo beta-lactámico (2).
Las bacterias pueden tener una resistencia natural o intrínseca a alguna(s) familias de antibióticos, la misma que ya este presente antes de que la bacteria se exponga al uso del agente terapéutico. Esta resistencia es dependiente de la variabilidad genética que sufre la bacteria en su evolución a través del tiempo. Este hecho ha podido ser comprobaba al exponer a antibióticos cepas de bacterias halladas en las profundidades de los glaciares en las regiones árticas de Canadá, con mas de 2,000 años de antigüedad, y que por tanto fueron 19 siglos precedentes al desarrollo de los antibióticos por el ser humano (3).
Por otro lado, la resistencia a un antibiótico puede ser adquirida por la bacteria. Esta se genera por mecanismos como pequeñas mutaciones (mutaciones puntifornes, a veces únicas), o grandes mutaciones (Transposición ó translocación de grandes cadenas) de su material genético. Otro mecanismo por el cual la bacteria puede adquirir resistencia es mediante la adquisición ó transmisión de genes de la resistencia intra ó inter- especies. Este intercambio de información de material genético usualmente extra-cromosómico se realiza mediante vehículos que trasladan el material de bacteria a bacteria, llamados integrones, bacteriófagos o transposones (4). Por ello una bacteria es capaz de adquirir la resistencia a un antibiótico sin necesidad de haber estado en contacto muchas veces con estos.
La bacteria puede ejercer diferentes mecanismos para su subsistencia y protección contra los antibióticos utilizan una serie de mecanismos llamados de Resistencia, que podemos resumir como sigue:
· Inactivación enzimatica del antibiótico, mecanismo en la que la bacteria genera una sustancia (enzima) que altera o destruye la estructura química de la molécula antibiótica (Ej. Betalactamasas para los antibióticos betalactamicos, aciltransferasas para los aminoglicosidos ó el cloranfenicol).
· Alteración de las barreras de permeabilidad, muy usado en bacterias gram negativas. Se describen dos mecanismos 1) Alterar los poros por los cuales penetra el antibiótico la membrana externa. 2) Eflujo activo: Se altera la producción de energía y se disminuye el ingreso del antibiótico y se promueve un mecanismo de expulsión activa del antimicrobiano.
· Alteración del sitio blanco, definiéndose sitio blanco como el lugar donde se une el antibiótico para ejercer su acción antimicrobiana. Los sitios blancos usualmente son proteínas de la membrana u otro componente de la estructura bacteriana que juega un rol en algún mecanismo que suele ser vital para la subsistencia o reproducción bacteriana. Ejemplo de esto es el proceso de crecimiento, respiración, elongación bacteriana, etc. La bacteria ejerce este mecanismo de resistencia modificando o cambiando estos sitios blanco, de forma tal que el antibiótico no pueda unirse, o ejercer acción sobre el PBP y por tanto no puede alterar este mecanismo del proceso de vida bacteriano.
La frecuencia y nivel de resistencia de bacteria a un antibiótico varía con relación a una serie de factores. La resistencia puede variar en el tiempo, además va a ser diferente en las diferentes áreas geográficas, dependiente de sí la bacteria reside en la comunidad ó en un centro de atención de salud, y dentro del mismo el nivel de resistencia va a variar dependiendo del nivel de complejidad de la Unidad Hospitalaria. Se ha determinado que existe una serie de factores de la práctica médica diaria:
· Frecuencia en el uso de antibióticos en el sistema.
· Uso racional de los mismos.
· La variación genética espontánea e inducida por la presión selectiva de los antibióticos sobre determinados gérmenes.
Un poco más de 60 años luego de la aparición de los antibióticos se describen serios problemas. En la actualidad se observa con frecuencia creciente, la presencia de infecciones por gérmenes multi-resistentes, causantes de afecciones que llevan a la muerte a pacientes, ante la incapacidad del médico de modificar el curso del proceso, por carencia de un agente terapéutico al que estos sean susceptibles.
En el ámbito comunitario se describe que un número importante de familias de antibióticos, entre las que se encuentra las sulfas, amino penicilinas, tetraciclinas, etc., están entrando en desuso para el manejo de afecciones frecuentes en la comunidad como lo son las infecciones urinarias, gastrointestinales y de vías respiratorias causadas por bacterias gram negativas, como las enterobacteriáceas, Salmonellas, Shigellas (5). Gérmenes que afectan las vías respiratorias, como Haemophilus influenzae, se describen en como Resistentes a las aminopencilinas en diferentes regiones geográficas. La resistencia de Neumococo a la penicilina se está globalizando, y tanto la frecuencia como el nivel de resistencia, van en incremento progresivo (6).
En los hospitales, son huéspedes susceptibles para adquirir infecciones por gérmenes nosocomiales tanto los pacientes que se internan como el personal que labora por bacterias gram negativas como Pseudomonas aeruginosa, Klebsiellas, han desarrollado Betalactamasas de espectro ampliado o cromosomiales, que inactivan las moléculas antibióticas más complejas (5) y por bacterias gram positivas como Enterococo ó Estafilococos Meticilino que tienen una incidencia creciente, casi exponencial en áreas críticas hospitalarias y son difíciles de tratar y controlar (7, 8).
El impacto de la resistencia bacteriana en la salud y en la economía de las personas, ó Instituciones de salud no ha sido correctamente determinado, pero se describe claramente que incrementa indicadores como mortalidad, morbilidad y costo hospitalario. Para el manejo de estas infecciones se consume de mayores recursos de salud y las cifras que se calculan se asume subestiman largamente los costos del manejo de este problema. Las cifras reportadas actualmente asumen que el gasto anual es un valor que se encuentra entre 100 millones a 30 billones de dólares (9,10).
La Resistencia de Staphylococcus aureus
Staphylococcus aureus ó estafilococo dorado fue identificado por primera vez en 1880 por un cirujano Alexander Ogston, quien lo encontró como agente causal de la mayoría de abscesos de partes blandas. Este agente puede causar enfermedad produciendo lesiones inflamatorias con contenido purulento, el cual puede progresar por contigüidad a estructuras mas profundas, y al llegar a torrente sanguíneo diseminarse y producir el mismo tipo de lesión en cualquier lugar del organismo. Adicionalmente, este agente tiene la capacidad de producir toxinas, las que aumentan la severidad del proceso, así exista una pequeña cantidad de agentes infecciosos.
El estafilococo en resumen puede generar cuadros locales por acumulo de pus, diseminación y siembra de otros focos a través de sistema vascular, cuadros de reacción inmunológica y cuadros asociados a toxinas (sustancias enzimáticas bacterianas que actúan como venenos). Por tanto se describe con frecuencia procesos focales como Foliculitis, inflamación con acumulo de pus alrededor del folículo piloso; forunculosis, colección purulenta rebasa el folículo piloso y forma un saco de pus circundado por un rodete inflamatorio que suele ser muy doloroso; Abscesos, que es un saco purulento que compromete varios niveles de planos tisulares. Ántrax, área de necrosis tisular. Infecciones como Celulitis donde el compromiso tegumentario es de piel y Tejido celular Subcutáneo, con una lesión inflamatoria difusa. Compromiso de planos más profundos como piomiositis, artritis u osteomilitis. Por vía hematógena puede afectar órganos nobles como corazón, pulmón ó Sistema Nervioso Central (SNC), causando infecciones severas como neumonía, endocarditis, meningoencefalitis y sepsis (11).
Los procesos relacionados a reacciones por toxina estafilococcica más conocidos son: el síndrome de piel escaldada, el síndrome de choque tóxico y el cuadro de intoxicación alimentaria. En todas estas entidades la cantidad de gérmenes presente suele ser pequeña y la severidad del cuadro se debe a la reacción que causa la toxina.
Staphylococcus epidermidis, un primo hermano del estafilococo dorado o Staphylococcus aureus, mantiene el mismo hábitat, y suele colonizar personal hospitalario. Produce una sustancia, slug ó adhesina, que le confiere una mayor afinidad por cierto tipo de estructuras corporales como válvulas cardiacas ó cartílagos. Coloniza muy fácilmente materiales plástico u otros, que son utilizados en la fabricación de válvulas prostéticas, implantes, catéteres, entre otros. Ingresa fácil y frecuentemente por brechas en piel originadas por inserciones de catéteres, heridas quirúrgicas y la colocación de implantes, válvulas, prótesis u otros contaminados. La infección por este agente, aunque más silente, y menos aparatosa que la infección por estafilococo dorado, suele ser más grave, ya que su ocurrencia se da usualmente en el ámbito hospitalario, y afecta a sujetos que usualmente tienen procesos mórbidos asociados y/o son sometidos a procedimientos complejos como pueden ser implante de prótesis, catéteres de drenaje, válvulas cardiacas, entre otros.
Flemming en el momento de descubrir la penicilina en 1928, encontró que era efectiva en tratamiento de infecciones por S. aureus, pero ya en 1946 la frecuencia de resistencia del Estafilococo dorado por betalactamasas era de 60% (12), dejando de lado el uso de las penicilinas naturales como agentes terapéuticos para este germen.
Hacia 1959 se obtiene, alterando la estructura química de las penicilinas naturales, una molécula antibiótica que es llamada meticilina, primera penicilina semi-sintética, que tiene la propiedad de evadir la acción de las Betalactamasas. Se consigue por tanto una familia de penicilinas que se convierte en el agente de elección para el tratamiento de infecciones por esta bacteria productora de betalactamasas debido a que la resistencia a penicilinas naturales alcanzó rápidamente cifras superiores al 90% (2).
Desde entonces, la meticilina y otras penicilinas semi-sintéticas como Oxacilina y sus derivados fluorados han sido los antibióticos de elección en el tratamiento de Estafilococo dorado. Como medicamentos de segunda línea se tienen otros betalactamicos como son Cefalosporinas de primera y segunda generación , y se puede usar además lincosamidas, cotrimoxazole y macrolidos (11).
Hacia 1960 se publica en Europa (Reino Unido) la aparición de la primera cepa de S. aureus con un nuevo mecanismo que le confiere resistencia a meticilina, en Europa, que tarda 8 años en ser descrita en América (EEUU) hacia 1968 (12), y aunque fueron en ese momento hechos aislados, son en este momento un problema de actualidad.
Se describe un grupo de cepas de Estafilococo dorado como cepas tolerantes, las que se definen como aquellas que tiene una disociación entre la Concentración Inhibitoria Mínima (CIM) del antibiótico y la Concentración Bactericida Mínima (CBM), que se manifiesta en el laboratorio como la elevación de la relación de estos dos parámetros de 1:4 a 1:32 o más (11). Esto en la practica significa que los antibióticos betalactamicos se comportan como agentes bacteriostáticos, y pierden su condición bactericida para este grupo de Estafilococos, lo que en la clínica se traduce en una menor respuesta clínica en el tratamiento de infecciones serias (11).
Otro grupo, de mucha mayor importancia es de Estafilococos Resistentes a Meticilina (MRSA). El mecanismo que confiere la resistencia a meticilina, es complejo, ya que la bacteria ha generado una variación genética, que se encuentra codificada en el gen mecA, por la cual modifica la estructura de su proteína de ligadora o fijadora a penicilina (PBP2a), lo que impide que la meticilina pueda adherirse al lugar donde va a ejercer la acción de bloquear la enzima transpeptidasa (cuya función en el ciclo de vida bacteriana es sintetizar la pared bacteriana) (13).
Este mecanismo confiere al Estafilococo dorado resistencia absoluta contra las penicilinas semi sintéticas (Meticilina y Oxacilina) y Cefalosporinas de primera y segunda generación, que son drogas indicadas. Pero además hace inútiles también a todos los Betalactamicos, incluyendo Cefalosporinas de tercera, cuarta generación y los Carbapenems (Imipenem, Meropenen). La resistencia conferida por este gen se extiende a otras familias antibióticas como las quinolonas y lincosamidas, lo que limita grandemente el armamentario terapéutico (2).
Algunas cepas de S. aureus han disminuido su sensibilidad a meticilina por un alto grado de producción de beta lactamasas, o producción de betalactamasas contra la meticilina, y probablemente posea otros mecanismos de resistencia que incluyan la modificación del PBP, o hiperproducción de PBP (14-16). A éste grupo se le ha catalogado como Estafilococo dorado con Resistencia limite a Oxacilina (BORSA, lo que en ingles se describe como "borderline oxacillin-resistant S. aureus"). Este grupo no responde al trataminto con las Penicilinas semi sintéticas, ni cefalosporinas, pero sí a Imipenem (Carbapenem).
La resistencia a meticilina del Staphylococcus epidermidis, primo hermano del Estafilococo dorado, es ampliamente conocida. Su forma de presentación es silente, larvada, complica pacientes complejos, su manejo es difícil, ya que la desfocalización del paciente suele requerir la reiteración de un acto quirúrgico, el retiro de los implantes, y el uso de antibióticos complejos (11). Sin embargo la frecuencia de infección por este agente es baja, el nicho ecológico está localizado en el ámbito hospitalario y no es de diseminación tan rápida y aparatosa como el estafilococo dorado. Por tanto, la agresividad de la infección de Staphylococcus epidermidis en comparación con Staphylococcus aureus, independiente de la severidad suele ser menor.
La resistencia a meticilina en cepas de S. aureus es un problema creciente en el ámbito mundial, ya que las cifras crecientes que se reportan son preocupantes, y el estafilococo dorado es un agente que se disemina fácilmente y el comportamiento el proceso es agresivo, con la que este agente no solo lleva resistencia a la meticilina, sino a la totalidad de antibióticos ß -lactámicos, incluyendo cefalosporinas y carbapenem.
La tasa de infección por MRSA ha aumentado durante las dos ultimas décadas, siendo reportada como la causa más común de infección nosocomial reportada en 1990-1996. El Sistema Nacional de Vigilancia de Infecciones Nosocomiales de Estados Unidos (NNIS), reportó un incremento del 40% en la frecuencia de cepas de MRSA hacia 1999, comparado con el basal de 1994–1998. Adicionalmente se describe que la mortalidad en sujetos que presentan bacteriemia por este agente se encuentra entre 15–60% (17,18).
MRSA es endémico en muchos hospitales, sobre todo aquellos que brindan atención compleja y tienen un alto número de camas (19), donde puede ser el agente causal de cerca del 50% de infecciones nosocomiales. Se ha convertido en muchos lugares como el primer agente causal implicado en neumonía nosocomial, infecciones quirúrgicas y bacteriemia nosocomial. El manejo de infecciones causadas por este agente incrementa los costos de $ 9,661 a $ 27,083 y las cifras de mortalidad de 8% a 21% (20, 21).
Estudios en el Perú muestran que existe una frecuencia de infección por MRSA elevada, sobretodo en hospitales de atención compleja, y en las unidades criticas y de atención a quemados. Echevarría y col. en 1995, realizaron un estudio en 6 centros hospitalarios de Lima, 4 Hospitales del Ministerio de Salud, 1 de las Fuerzas Armadas y uno de Seguridad Social, en que se colectaron 423 cepas de Staphyloccocus spp. Referidas a los laboratorios de microbioogias de los pacientes infectados en unidades complejas como UCI, Unidades de Quemados, centros de terapia de Cáncer, Unidades de Cirugía compleja. Para determinar la sensibilidad de estas cepas a meticilina se utilizó el test de Sensibilidad en placa (NSSLS) con discos de oxacillina. Se encontró una frecuencia de Estafilococos metilino resistentes de 58%. La distribución por centro hospitalario se observa en la tabla N°1 tabla N°1 (22).
Datos similares, pero con estudios que incluyeron un menor número de cepas fueron reportados por Cornejo, en un estudio de vigilancia de resistencia a oxacilina que realizó en el Hospital Nacional del Sur de Arequipa (IPSS) (23), y por Sánchez Hurtado (24) en la UCI del Hospital Nacional Arzobispo Loayza el mismo año. Estudios posteriores realizadas en otros centros hospitalarios de nuestro medio muestran cifras similares (25, 26).
Factores de riesgo para adquirir MRSA
En los hospitales los organismos pueden diseminarse de paciente a paciente, siendo el vehículo de transmisión el personal hospitalario (27). La frecuencia de portador nasal en el personal hospitalario varía entre 5-10% (28). También los pacientes pueden adquirir la infección a través del uso de productos contaminados como antisépticos y otros objetos inanimados y la forma de transmisión puede variar de un sistema de salud a otro (29,30).
Los factores de riesgo que son demostrados en la mayoría de estudios, con relación a infección nosocomial por MRSA son: Estancia prolongada hospitalaria, uso de antibióticos de amplio espectro, estancia en UCI o unidad de quemados, infecciones quirúrgicas, úlceras de decúbito, pobre estado funcional, proximidad a otro paciente con MRSA (11,14).
MRSA en la comunidad
Existen múltiples reportes de sujetos provenientes de la comunidad, que se internan en los hospitales por infecciones en las cuales es detectado MRSA. La mayoría de ellos no pueden ser catalogados de infección nosocomial, por la definición vigente. Sin embargo, buena parte de ellos son sujetos que tiene la historia de haber estado internados previamente, y hay que considerar que el estado de portador en narinas por MRSA puede ser por tiempos de latencia prolongados.
Existe otro grupo de sujetos que no tiene el dato de haber estado internado previamente, pero tiene el antecedente de haber visitado en un hospital a un paciente infectado por MRSA, o de haber recibido a un familiar portador de MRSA en casa, luego de su alta hospitalaria (31). Aquí se debe considerar persona de riesgo al familiar de un personal de salud.
Otro grupo de pacientes importantes, y que es población puente para el traslado de MRSA a la comunidad, son pacientes que asisten a los hospitales y requieren terapias parenterales intravenosas (Diabéticos insulinodependientes y hemodiálisis); Así mismo los usuarios de drogas intravenosas (32,33).
Otros grupos de riesgo para adquirir MRSA en la comunidad son los niños y ancianos que son Institucionalizados, en guarderías o casas de reposo. A diferencia de las cepas provenientes del hospital, que suelen ser multiresistentes, las cepas de MRSA que afectan a este grupo de pacientes, suelen ser resistentes a los betalactamicos, pero guardan susceptibilidad a otras familias de antibióticos (34).
Un estudio hecho en la comunidad en la que evaluó 500 sujetos de la comunidad con hisopado nasal y se asiló 162 cepas portadores nasales de Estafilococo, encontrándose solo 1 cepa de MRSA, y este fue un sujeto con antecedente de haberse internado previamente en un hospital (31).
Por tanto, en la mayoría de los casos de sujetos que se internan por una infección por MRSA, se detecta algún factor de exposición hospitalaria, y en menor cuantía reciben algún cuidado de salud ó son usuarios de drogas intravenosas, restringiéndose el nicho ecológico de MRSA en la comunidad al grupo familiar de sujetos expuestos hospitalariamente. Aunque no existe una evidencia sólida a la fecha de que MRSA sé este diseminando en la comunidad desde personas sin factor de riesgo, cada vez se reportan mas casos de personas en las que no se detecta factor de exposición (17,35).
Epidemias por MRSA
MRSA puede presentarse en brotes epidémicos, cuando esto ocurre la mortalidad y los costos hospitalarios se incrementan. Estos brotes están usualmente relacionados a un incremento en la colonización de personal hospitalario y/o a la admisión reciente de un paciente previamente colonizado (36).
En la comunidad se ha reportado brotes entre los usuarios de drogas intravenosas y casas de reposo para niños y ancianos (32).
Para evitar estos brotes a nivel nosocomial, los expertos recomiendan se haga un tamizaje con cultivos para la detección de MRSA en narinas a todo paciente que se hospitalice y que tenga factores de riesgo como: (i) antecedente de haber tenido infección o colonización previa por MRSA (ii), ser procedente de una casa de reposo en la cual se hallan presentado previamente casos de infección por MRSA, (iii) Antecedente de hospitalización previa (iv) y sujetos expuestos a accesos vasculares prolongados o frecuentes (Drogadictos IV, diabéticos insulino dependientes, pacientes en hemodiálisis, etc. pertenecer a un grupo) (36).
Las principales recomendaciones para evitar la propagación de infecciones por MRSA incluyen el lavado de manos, a islamiento de persona afectada, uso de guantes y mascaras en la manipulación del paciente y el ambiente del paciente infectado.
El estafilococo en resumen puede generar cuadros locales por acumulo de pus, diseminación y siembra de otros focos a través de sistema vascular, cuadros de reacción inmunológica y cuadros asociados a toxinas (sustancias enzimáticas bacterianas que actúan como venenos). Por tanto se describe con frecuencia procesos focales como Foliculitis, inflamación con acumulo de pus alrededor del folículo piloso; forunculosis, colección purulenta rebasa el folículo piloso y forma un saco de pus circundado por un rodete inflamatorio que suele ser muy doloroso; Abscesos, que es un saco purulento que compromete varios niveles de planos tisulares. Ántrax, área de necrosis tisular. Infecciones como Celulitis donde el compromiso tegumentario es de piel y Tejido celular Subcutáneo, con una lesión inflamatoria difusa. Compromiso de planos más profundos como piomiositis, artritis u osteomilitis. Por vía hematógena puede afectar órganos nobles como corazón, pulmón ó Sistema Nervioso Central (SNC), causando infecciones severas como neumonía, endocarditis, meningoencefalitis y sepsis (11).
Los procesos relacionados a reacciones por toxina estafilococcica más conocidos son: el síndrome de piel escaldada, el síndrome de choque tóxico y el cuadro de intoxicación alimentaria. En todas estas entidades la cantidad de gérmenes presente suele ser pequeña y la severidad del cuadro se debe a la reacción que causa la toxina.
Staphylococcus epidermidis, un primo hermano del estafilococo dorado o Staphylococcus aureus, mantiene el mismo hábitat, y suele colonizar personal hospitalario. Produce una sustancia, slug ó adhesina, que le confiere una mayor afinidad por cierto tipo de estructuras corporales como válvulas cardiacas ó cartílagos. Coloniza muy fácilmente materiales plástico u otros, que son utilizados en la fabricación de válvulas prostéticas, implantes, catéteres, entre otros. Ingresa fácil y frecuentemente por brechas en piel originadas por inserciones de catéteres, heridas quirúrgicas y la colocación de implantes, válvulas, prótesis u otros contaminados. La infección por este agente, aunque más silente, y menos aparatosa que la infección por estafilococo dorado, suele ser más grave, ya que su ocurrencia se da usualmente en el ámbito hospitalario, y afecta a sujetos que usualmente tienen procesos mórbidos asociados y/o son sometidos a procedimientos complejos como pueden ser implante de prótesis, catéteres de drenaje, válvulas cardiacas, entre otros.
Flemming en el momento de descubrir la penicilina en 1928, encontró que era efectiva en tratamiento de infecciones por S. aureus, pero ya en 1946 la frecuencia de resistencia del Estafilococo dorado por betalactamasas era de 60% (12), dejando de lado el uso de las penicilinas naturales como agentes terapéuticos para este germen.
Hacia 1959 se obtiene, alterando la estructura química de las penicilinas naturales, una molécula antibiótica que es llamada meticilina, primera penicilina semi-sintética, que tiene la propiedad de evadir la acción de las Betalactamasas. Se consigue por tanto una familia de penicilinas que se convierte en el agente de elección para el tratamiento de infecciones por esta bacteria productora de betalactamasas debido a que la resistencia a penicilinas naturales alcanzó rápidamente cifras superiores al 90% (2).
Desde entonces, la meticilina y otras penicilinas semi-sintéticas como Oxacilina y sus derivados fluorados han sido los antibióticos de elección en el tratamiento de Estafilococo dorado. Como medicamentos de segunda línea se tienen otros betalactamicos como son Cefalosporinas de primera y segunda generación , y se puede usar además lincosamidas, cotrimoxazole y macrolidos (11).
Hacia 1960 se publica en Europa (Reino Unido) la aparición de la primera cepa de S. aureus con un nuevo mecanismo que le confiere resistencia a meticilina, en Europa, que tarda 8 años en ser descrita en América (EEUU) hacia 1968 (12), y aunque fueron en ese momento hechos aislados, son en este momento un problema de actualidad.
Se describe un grupo de cepas de Estafilococo dorado como cepas tolerantes, las que se definen como aquellas que tiene una disociación entre la Concentración Inhibitoria Mínima (CIM) del antibiótico y la Concentración Bactericida Mínima (CBM), que se manifiesta en el laboratorio como la elevación de la relación de estos dos parámetros de 1:4 a 1:32 o más (11). Esto en la practica significa que los antibióticos betalactamicos se comportan como agentes bacteriostáticos, y pierden su condición bactericida para este grupo de Estafilococos, lo que en la clínica se traduce en una menor respuesta clínica en el tratamiento de infecciones serias (11).
Otro grupo, de mucha mayor importancia es de Estafilococos Resistentes a Meticilina (MRSA). El mecanismo que confiere la resistencia a meticilina, es complejo, ya que la bacteria ha generado una variación genética, que se encuentra codificada en el gen mecA, por la cual modifica la estructura de su proteína de ligadora o fijadora a penicilina (PBP2a), lo que impide que la meticilina pueda adherirse al lugar donde va a ejercer la acción de bloquear la enzima transpeptidasa (cuya función en el ciclo de vida bacteriana es sintetizar la pared bacteriana) (13).
Este mecanismo confiere al Estafilococo dorado resistencia absoluta contra las penicilinas semi sintéticas (Meticilina y Oxacilina) y Cefalosporinas de primera y segunda generación, que son drogas indicadas. Pero además hace inútiles también a todos los Betalactamicos, incluyendo Cefalosporinas de tercera, cuarta generación y los Carbapenems (Imipenem, Meropenen). La resistencia conferida por este gen se extiende a otras familias antibióticas como las quinolonas y lincosamidas, lo que limita grandemente el armamentario terapéutico (2).
Algunas cepas de S. aureus han disminuido su sensibilidad a meticilina por un alto grado de producción de beta lactamasas, o producción de betalactamasas contra la meticilina, y probablemente posea otros mecanismos de resistencia que incluyan la modificación del PBP, o hiperproducción de PBP (14-16). A éste grupo se le ha catalogado como Estafilococo dorado con Resistencia limite a Oxacilina (BORSA, lo que en ingles se describe como "borderline oxacillin-resistant S. aureus"). Este grupo no responde al trataminto con las Penicilinas semi sintéticas, ni cefalosporinas, pero sí a Imipenem (Carbapenem).
La resistencia a meticilina del Staphylococcus epidermidis, primo hermano del Estafilococo dorado, es ampliamente conocida. Su forma de presentación es silente, larvada, complica pacientes complejos, su manejo es difícil, ya que la desfocalización del paciente suele requerir la reiteración de un acto quirúrgico, el retiro de los implantes, y el uso de antibióticos complejos (11). Sin embargo la frecuencia de infección por este agente es baja, el nicho ecológico está localizado en el ámbito hospitalario y no es de diseminación tan rápida y aparatosa como el estafilococo dorado. Por tanto, la agresividad de la infección de Staphylococcus epidermidis en comparación con Staphylococcus aureus, independiente de la severidad suele ser menor.
La resistencia a meticilina en cepas de S. aureus es un problema creciente en el ámbito mundial, ya que las cifras crecientes que se reportan son preocupantes, y el estafilococo dorado es un agente que se disemina fácilmente y el comportamiento el proceso es agresivo, con la que este agente no solo lleva resistencia a la meticilina, sino a la totalidad de antibióticos ß -lactámicos, incluyendo cefalosporinas y carbapenem.
La tasa de infección por MRSA ha aumentado durante las dos ultimas décadas, siendo reportada como la causa más común de infección nosocomial reportada en 1990-1996. El Sistema Nacional de Vigilancia de Infecciones Nosocomiales de Estados Unidos (NNIS), reportó un incremento del 40% en la frecuencia de cepas de MRSA hacia 1999, comparado con el basal de 1994–1998. Adicionalmente se describe que la mortalidad en sujetos que presentan bacteriemia por este agente se encuentra entre 15–60% (17,18).
MRSA es endémico en muchos hospitales, sobre todo aquellos que brindan atención compleja y tienen un alto número de camas (19), donde puede ser el agente causal de cerca del 50% de infecciones nosocomiales. Se ha convertido en muchos lugares como el primer agente causal implicado en neumonía nosocomial, infecciones quirúrgicas y bacteriemia nosocomial. El manejo de infecciones causadas por este agente incrementa los costos de $ 9,661 a $ 27,083 y las cifras de mortalidad de 8% a 21% (20, 21).
Estudios en el Perú muestran que existe una frecuencia de infección por MRSA elevada, sobretodo en hospitales de atención compleja, y en las unidades criticas y de atención a quemados. Echevarría y col. en 1995, realizaron un estudio en 6 centros hospitalarios de Lima, 4 Hospitales del Ministerio de Salud, 1 de las Fuerzas Armadas y uno de Seguridad Social, en que se colectaron 423 cepas de Staphyloccocus spp. Referidas a los laboratorios de microbioogias de los pacientes infectados en unidades complejas como UCI, Unidades de Quemados, centros de terapia de Cáncer, Unidades de Cirugía compleja. Para determinar la sensibilidad de estas cepas a meticilina se utilizó el test de Sensibilidad en placa (NSSLS) con discos de oxacillina. Se encontró una frecuencia de Estafilococos metilino resistentes de 58%. La distribución por centro hospitalario se observa en la tabla N°1 tabla N°1 (22).
Datos similares, pero con estudios que incluyeron un menor número de cepas fueron reportados por Cornejo, en un estudio de vigilancia de resistencia a oxacilina que realizó en el Hospital Nacional del Sur de Arequipa (IPSS) (23), y por Sánchez Hurtado (24) en la UCI del Hospital Nacional Arzobispo Loayza el mismo año. Estudios posteriores realizadas en otros centros hospitalarios de nuestro medio muestran cifras similares (25, 26).
Factores de riesgo para adquirir MRSA
En los hospitales los organismos pueden diseminarse de paciente a paciente, siendo el vehículo de transmisión el personal hospitalario (27). La frecuencia de portador nasal en el personal hospitalario varía entre 5-10% (28). También los pacientes pueden adquirir la infección a través del uso de productos contaminados como antisépticos y otros objetos inanimados y la forma de transmisión puede variar de un sistema de salud a otro (29,30).
Los factores de riesgo que son demostrados en la mayoría de estudios, con relación a infección nosocomial por MRSA son: Estancia prolongada hospitalaria, uso de antibióticos de amplio espectro, estancia en UCI o unidad de quemados, infecciones quirúrgicas, úlceras de decúbito, pobre estado funcional, proximidad a otro paciente con MRSA (11,14).
MRSA en la comunidad
Existen múltiples reportes de sujetos provenientes de la comunidad, que se internan en los hospitales por infecciones en las cuales es detectado MRSA. La mayoría de ellos no pueden ser catalogados de infección nosocomial, por la definición vigente. Sin embargo, buena parte de ellos son sujetos que tiene la historia de haber estado internados previamente, y hay que considerar que el estado de portador en narinas por MRSA puede ser por tiempos de latencia prolongados.
Existe otro grupo de sujetos que no tiene el dato de haber estado internado previamente, pero tiene el antecedente de haber visitado en un hospital a un paciente infectado por MRSA, o de haber recibido a un familiar portador de MRSA en casa, luego de su alta hospitalaria (31). Aquí se debe considerar persona de riesgo al familiar de un personal de salud.
Otro grupo de pacientes importantes, y que es población puente para el traslado de MRSA a la comunidad, son pacientes que asisten a los hospitales y requieren terapias parenterales intravenosas (Diabéticos insulinodependientes y hemodiálisis); Así mismo los usuarios de drogas intravenosas (32,33).
Otros grupos de riesgo para adquirir MRSA en la comunidad son los niños y ancianos que son Institucionalizados, en guarderías o casas de reposo. A diferencia de las cepas provenientes del hospital, que suelen ser multiresistentes, las cepas de MRSA que afectan a este grupo de pacientes, suelen ser resistentes a los betalactamicos, pero guardan susceptibilidad a otras familias de antibióticos (34).
Un estudio hecho en la comunidad en la que evaluó 500 sujetos de la comunidad con hisopado nasal y se asiló 162 cepas portadores nasales de Estafilococo, encontrándose solo 1 cepa de MRSA, y este fue un sujeto con antecedente de haberse internado previamente en un hospital (31).
Por tanto, en la mayoría de los casos de sujetos que se internan por una infección por MRSA, se detecta algún factor de exposición hospitalaria, y en menor cuantía reciben algún cuidado de salud ó son usuarios de drogas intravenosas, restringiéndose el nicho ecológico de MRSA en la comunidad al grupo familiar de sujetos expuestos hospitalariamente. Aunque no existe una evidencia sólida a la fecha de que MRSA sé este diseminando en la comunidad desde personas sin factor de riesgo, cada vez se reportan mas casos de personas en las que no se detecta factor de exposición (17,35).
Epidemias por MRSA
MRSA puede presentarse en brotes epidémicos, cuando esto ocurre la mortalidad y los costos hospitalarios se incrementan. Estos brotes están usualmente relacionados a un incremento en la colonización de personal hospitalario y/o a la admisión reciente de un paciente previamente colonizado (36).
En la comunidad se ha reportado brotes entre los usuarios de drogas intravenosas y casas de reposo para niños y ancianos (32).
Para evitar estos brotes a nivel nosocomial, los expertos recomiendan se haga un tamizaje con cultivos para la detección de MRSA en narinas a todo paciente que se hospitalice y que tenga factores de riesgo como: (i) antecedente de haber tenido infección o colonización previa por MRSA (ii), ser procedente de una casa de reposo en la cual se hallan presentado previamente casos de infección por MRSA, (iii) Antecedente de hospitalización previa (iv) y sujetos expuestos a accesos vasculares prolongados o frecuentes (Drogadictos IV, diabéticos insulino dependientes, pacientes en hemodiálisis, etc. pertenecer a un grupo) (36).
Las principales recomendaciones para evitar la propagación de infecciones por MRSA incluyen el lavado de manos, a islamiento de persona afectada, uso de guantes y mascaras en la manipulación del paciente y el ambiente del paciente infectado.
Surgimiento del Staphylococcus aureus Vancomicina Resistente
Lamentablemente a pesar de todos los esfuerzos por conseguir nuevas moléculas antibióticas para contrarrestar el surgimiento de resistencia bacteriana, hoy en día nos vemos amenazados por el surgimiento de cepas de S. aureus con resistencia intermedia a vancomicina (VISA), el que fue descrito por primera vez en mayo de 1996 en Japón, reportándose luego en Estados Unidos en pacientes con infección por MRSA que reciben vancomicina por tiempo prolongado, diálisis, quienes tuvieron pobre respuesta a vancomicina, y esta resistencia intermedia sea un paso al surgimiento y desarrollo de resistencia a vancomicina y uno hoy en día debe estar alerta si un paciente no responde en forma adecuada al tratamiento con vancomicina constituyendo por ello un potencial problema de salud publico (37- 41).
El mecanismo de resistencia es diferente al descrito para enterococo, siendo por ello necesaria la combinación de dos o más antibióticos para contrarrestar estos procesos infecciosos (42).
Finalmente la habilidad de estos gérmenes para desarrollar Resistencia hace sombrío el panorama terapéutico, ya que la obtención de nuevas moléculas antibióticas es un proceso largo, y la vigencia del mismo es corta (43).
Nuevos medicamentos y terapia actual
La Vancomicina fue el primer glicopeptido que se aisló del Streptomyces orientalis, existiendo actualmente en el mercado 2 moléculas (Vancomicina y Teicoplanina) y 2 más en investigación (Daptomicin y Ramoplanin), estos antibióticos han cobrado un auge tremendo con relación a la aparición de Staphylococcus aureus meticilino resistentes y Enterococos multiresistentes
Mecanismo de acción: Inhibe el segundo paso de la síntesis del peptidoglucano de la pared celular, uniendose a los precursores de la D-alanil-D-alanina y además, altera la permeabilidad de la membrana citoplasmática, teniendo efecto post-antibiótico.
La vía de administración de ambos antibióticos (Vancomicina y teicoplanina) se administran por vía endovenosa, Vancomicina debe de administrarse lentamente por el riesgo de liberación de histamina por los mastocitos, lo que puede desencadenar flushing (síndrome de hombre rojo), reacción anafiláctica, hipotensión y falla cardiaca, no existiendo presentación intramuscular, ni absorción oral, lo que limita el empleo de esta droga en forma ambulatoria.
La eliminación es por vía glomerular, teniendo una vida media: 6-8 horas, con una unión de 10 - 55% a proteínas, siendo eliminada por via renal 80 -90% sin metabolizar por lo que debe corregirse con caída de la depuración de creatinina, el resto sé metaboliza en el hígado con una eliminación muy pobre en heces.
No atraviesa barrera hemato-encefálica, excepto en cantidades terapéuticas cuando las meninges se encuentran inflamadas.
La toxicidad que se reporta más frecuentemente es fiebre, escalofríos y flebitis, como también Síndrome de hombre rojo debido a la liberación de histamina, otros efectos tóxicos que es necesario tener en cuenta son leucopenia y trombocitopenia reversibles, toxicidad auditiva con perdida de audición a tonos altos, que se presenta a dosis mayores de 80 mg/L, y nefrotoxicidad (aumenta asociada a aminoglicósidos).
Teicoplanina a diferencia de vancomicina es más lipofílico, por lo que tiene mayor penetración intracelular, siendo su vida media más larga (40 - 70 hrs.), tiene alta unión proteica y lento aclaramiento renal, existiendo presentación intra-muscular con adecuada penetración tisular en general.
Efectos adversos renales y hombre rojo se describen también pero en menor frecuencia que con Vancomicina
LINEZOLID Es una nueva clase de antimicrobianos sintéticos: oxazolidinonas que actúan al inhibir de síntesis de proteínas a nivel de 50S, teniendo como gran ventaja una biodisponibilidad oral cercana al 100%, teniendo un espectro de acción contra bacterias Gram positivas y dentro de ellas de S. aureus resistente a meticilina (MRSA) y GISA.
Dentro de sus propiedades farmacológicas, tenemos una biodisponibilidad cercana a 100% (pico 1-2h) con una baja fijación a proteínas, siendo eliminada en un 30-35% por orina sin modificación, teniendo una vida media de eliminación de 5-7 horas.
Los efectos adversos descritos en los diferentes estudios clínicos en muchos de los cuales participó nuestro país figuran nauseas, diarrea y cefalea (2%), incremento leve en transaminasas, amilasa y lipasa, toxicidad hematológica como trombocitopenia y coloración oscura de la lengua.
Linezolid es seguro y bien tolerado en adultos a dosis de 600 mg. BID por hasta 28 días
ESTREPTOGRAMINAS: Este nuevo grupo de antibióticos es derivado del Streptomyces pristinaspiralis (pristinamicin, virginamicin, synercid), los cuales son de acción bactericida al inhibir la función ribosomal 50S siendo los usos clínicos aprobados para FDA: Infecciones de piel y partes blandas, infecciones por gram positivos resistentes y dentro de ellos se encuentra MRSA.
EVERNINOMICINA: Estos antibióticos oligosacaridos en fase de evaluación II y III (Avilamycin, evernimicin) se presentan en preparados parenterales, describiéndose actividad in vitro contra S. aureus Meticilina resistente, existiendo al momento limitada información sobre eficacia: infecciones de piel, respiratorias.
Control de la resistencia a los antibióticos
En la práctica clínica la aparición de bacterias resistentes a los antibióticos se ha relacionado con el excesivo uso de determinados antibióticos y el decremento en el uso de otros, a pesar de que la relación de causalidad no se puede definir completamente. El genoma bacteriano contiene complejas cadenas de genes que codifican la resistencia para uno o más antibióticos. Así, el uso de un antibiótico puede seleccionar la aparición de resistencia a otro. Aunque la aparición de resistencia a los antibióticos es inevitable, el uso racional de estos fármacos puede disminuir la velocidad a la que se desarrolla.
El estudio de la genética de la resistencia a los antibióticos, en particular el conocimiento de la gran transmisibilidad de plásmidos y transposones entre bacterias lleva a concluir que cada antibiótico tiene la capacidad de alterar de manera inexorable su micro ambiente y crear ventajas selectivas para microorganismos resistentes.
REFERENCIAS BIBLIOGRAFICAS
1. Burke A. Antibiotic Resistance, Medical Clinic of North America 84(6) 2000.
2. Turnidge J, Chang FY, Fowler VG. Staphylococcus aureus: Antimicrobial Therapy and Vaccines 2002Second Edition 631-58.
3. Fernández F, Lopez J, ponce LM, Machado C. Resistencia Bacteriana: Rev. Cubana Med. Milit. 2003;32(1): 44-8.
4. Jacoby GA, Archer GL. New mechanism of bacterial resistance to antimicrobial agents. N. Engl. J. Med. N Engl J Med. 1991 Feb 28;324(9):601-12.
5. Sanders CC, Sanders WE Jr. beta-Lactam resistance in gram-negative bacteria: global trends and clinical impact Clin Infect Dis. 1992 Nov;15(5):824-39.
6. Tan TQ. Antibiotic resistant infections due to Streptococcus pneumoniae: impact on therapeutic options and clinical outcome Curr Opin Infect Dis. 2003;16(3):271-7.
7. Ayliffe GAJ. The progressive Intercontinental Spread of methicillin-resistant Staphylococcus aureus . Clin Infect Dis 1997; 24: S74-S79.
8. Kaye KS, Fraimow HS, Abrutyn E. Pathogens Resistant to Antimicrobial Agents. Inf Dis Clin NA 2000; 2: 293-319.
9. Neu HC. The crisis in antibiotic resistance; Science. 1992 ;257(5073):1064-73.
10. Levy SB. The challenge of antibiotic resistance. Sci Am. 1998;278(3):46-53.
11. Mandell. Principles And Practice on Infectious Diseases. Fifth Edition 2000.
12. Lyon BR & Skurray R. Antimicrobial resistance of Sthaphylococcus aureus: Genetic basis. Microbiological reviews 1987; 51: 88-134.
13. Boyce JM. Methicillin resistan Staphylococcus aureus. Infect Dis Clin North Am 1989;3:901-13.
14. Lowy FD. Staphylococcus aureus Infections.NEJM 1998; 339:520-532.
15. Brumfitt W, Hamilton-Miller J. Methicillin-resistant Staphylococcus aureus NEJM 1989; 320:1188-1196.
16. Montanari MP, Tonin E, et al. Further characterization of borderline methicillin resistant Staphylococcus aureus and anallisis of penicillin binding proteins. Antimicrob Agents Chemoter, 1990;34:911–913.
17. Cosgrove SE, Sakoulas G, Perencevich EN, Schwaber MJ, Karchmer AW, Carmeli Y. Comparison of Mortality Associated with Methicillin-Resistant and Methicillin-Susceptible Staphylococcus aureus Bacteremia: A Meta-analysis. Clinical Infectious Diseases 2003;36:53-59.
18. Melzer M, Eykyn SJ, Gransden WR,Chinn S. Is Methicillin-Resistant Staphylococcus aureus More virulent than Methicillin-Susceptible S. aureus? A comparative cohort Study of British Patients with Nosocomial Infection and bacteremia . CID 2003; 37: 1453-60.
19. Weistein RA. Nosocomial Infection Update. Emerg Infect Dis. 1998 July-Sept;4:1-5.
20. Rubin RJ, Harrington CA, Poon A, Dietrich K, Greene JA, Moiduddin A. The economic impact of Staphylococcus aureus infection in New York City hospitals. Emerg Infect Dis. 1999;5: 9-17.
21. Abramson MA, Sexton DJ. Nosocomial methicillin-resistant and methicillin susceptible Staphylococcus aureus primary bacteremia: At Wath Cost. Infection Control and Hospital Epidemiology 199; 20: 408-11.
22. Echevarria JE, Ore L, Zerpa R, Campana C, Quispe V, Tamariz J, Prada A, Guerra H, Casas J. Prevalence of Methicillin Resitant Staphylococcus strains, in Hospitalized patients and susceptibility to Teicoplanin in Lima Peru. 20th International Congress of Chemotherapy. Sidney- Australia. Junio 1997. International Society of Chemotherapy. Libro de Resúmenes.
23. Cornejo M, Azpilcueta, et al. Staphylococcus aureus resistente a oxacilina en el servicio de medicina interna del HNSA. Boletín de la Sociedad Peruana de Enfermedades Infecciosas y Tropicales-SPEIT. 1995;4(2):66.
24. Sánchez L, Carrillo L, et al. Resistencia antibiótica de Estafilococos en el Hospital Arzobispo Loayza en Lima. Boletín de la Sociedad Peruana de Enfermedades Infecciosas y Tropicales-SPEIT. 1997;7:09-11.
25. Guerra J, Sánchez I, et al. Staphylococcus aureus resistente a oxacilina en el Hospital Carrión. Boletín de la Sociedad Peruana de Enfermedades Infecciosas y Tropicales-SPEIT. 1997;6(2):40.
26. Siguas A, Salazar N, et al. Susceptibilidad del Staphylococcus en un servicio de medicina. Boletín de la Sociedad Peruana de Enfermedades Infecciosas y Tropicales-SPEIT. 1997;6(2):41.
27. Gil A, Gaspar M, Sánchez P, Coello R, Fereres J. Personal sanitario como fuente de infección de un brote nosocomial de Staphylococcus aureus resistente a meticilina. Enferm Infec Microbiol Clin 1997;15:173-4.
28. Reagan DR, Doebbeling BN, Pfaller MA, Sheetz CT, Houston AK, Hollis RJ, Wenzel RP. Elimination of coincident Staphylococcus aureus nasal and hand carriage with intranasal application of mupirocin calcium ointment. Ann Intern Med 1991; 114:101-6.
29. Assadian O, Daxboeck F, Aspoeck C, Blacky A, Dunkl R, Koller W. National Survillance of Methicillin-sensitive and Methicillin-Resistant Staphylococcus aureus in Austrian Hospitals: 1994-1998. Journal of Hospital Infections 2003; 55: 175-79.
30. Chambers HF. The Changing Epidemiology of Staphylococcus aureus. Emerg Infect Dis. 2001;7 : 178-182.
31. Shopsin B, Mathema B, Martinez J, et al . Prevalence of methicillin-resistant and methicillin-susceptible Staphylococcus aureus in the community. J. Infect Dis. 2000;182(1):359-62.
32. Salgado CD, Farr BM, Calfee DP. Community-acquired methicillin-resistant Staphylococcus aureus: a meta-analysis of prevalence and risk factors. Clin Infect Dis. 2003;36(2):131-9.
33. Salmenlenna S, Lyytikainen O and Vuopio-Varkila. Community-acquired methicillin-resistant Staphylococcus aureus, Finland. Emerg Infect Dis. 2002; 8: 602-7.
34. Chambers HF. Methicillin resistance in staphylococci: molecular and biochemical basis and clinical implications. Clin Microbiol Rev. 1997 Oct;10(4):781-91. Review.
35. Naimi TS , LeDell KH, Como-Sabetti K, et al. Comparison of Community and Health Care Associated Methicillin Resistant Staphylococcus aureus Infections. JAMA, 2003; 290: 2976 - 2984.
36. Papia G, Louie M, Tralla A, Johnson C, Collins V, Simor AE. Screening high-risk patients for methicillin-resistant Staphylococcus aureus on admission to the hospital: is it cost effective? Infect Control Hosp Epidemiol. 1999 Jul;20(7):473-7.
37. Smith TL, Pearson ML, Wilcox KR, Cruz C, Lancaster MV, et al. Emergence of Vancomycin resistance in Staphylococcus aureus NEJM 1999 7 493-501.
38. Waldvogel FA. New Resistance in Staphylococcus aureus. NEJM 1999; 340:555-57.
39. Charles PG, Ward PB, Johnson PD, Howden BP, Grayson ML. Clinical features associated with bacteremia due to heterogeneous vancomycin-intermediate Staphylococcus aureus Clin Infect Dis 2004;38(3):448-51.
40. Hiramatsu K, Hanaki H, Ino T, et al. Methicillin-resistant Staphylococcus aureus clinical strain with reduced vancomycin susceptibility. J Antimicr. Chemoter 1997;40:135-6.
41. Tenover FC, Biddle JW and Lancaster MV. Increasing resistance to vancomycin and other glycopeptides in Staphylococcus aureus. Emerg Infect Dis. 2001; 7: 327-32.
42. Gutman M. Methicillin-resistant S.aureus and vancomicin-resistant enterococci: therapeutic r ealities and possibilities. Lancet 1997;349:1901-06.
43. Powers JH. Development of drugs for antimicrobial-resistant pathogens Curr Opin Infect Dis 2003;16(6):547-51.
El mecanismo de resistencia es diferente al descrito para enterococo, siendo por ello necesaria la combinación de dos o más antibióticos para contrarrestar estos procesos infecciosos (42).
Finalmente la habilidad de estos gérmenes para desarrollar Resistencia hace sombrío el panorama terapéutico, ya que la obtención de nuevas moléculas antibióticas es un proceso largo, y la vigencia del mismo es corta (43).
Nuevos medicamentos y terapia actual
La Vancomicina fue el primer glicopeptido que se aisló del Streptomyces orientalis, existiendo actualmente en el mercado 2 moléculas (Vancomicina y Teicoplanina) y 2 más en investigación (Daptomicin y Ramoplanin), estos antibióticos han cobrado un auge tremendo con relación a la aparición de Staphylococcus aureus meticilino resistentes y Enterococos multiresistentes
Mecanismo de acción: Inhibe el segundo paso de la síntesis del peptidoglucano de la pared celular, uniendose a los precursores de la D-alanil-D-alanina y además, altera la permeabilidad de la membrana citoplasmática, teniendo efecto post-antibiótico.
La vía de administración de ambos antibióticos (Vancomicina y teicoplanina) se administran por vía endovenosa, Vancomicina debe de administrarse lentamente por el riesgo de liberación de histamina por los mastocitos, lo que puede desencadenar flushing (síndrome de hombre rojo), reacción anafiláctica, hipotensión y falla cardiaca, no existiendo presentación intramuscular, ni absorción oral, lo que limita el empleo de esta droga en forma ambulatoria.
La eliminación es por vía glomerular, teniendo una vida media: 6-8 horas, con una unión de 10 - 55% a proteínas, siendo eliminada por via renal 80 -90% sin metabolizar por lo que debe corregirse con caída de la depuración de creatinina, el resto sé metaboliza en el hígado con una eliminación muy pobre en heces.
No atraviesa barrera hemato-encefálica, excepto en cantidades terapéuticas cuando las meninges se encuentran inflamadas.
La toxicidad que se reporta más frecuentemente es fiebre, escalofríos y flebitis, como también Síndrome de hombre rojo debido a la liberación de histamina, otros efectos tóxicos que es necesario tener en cuenta son leucopenia y trombocitopenia reversibles, toxicidad auditiva con perdida de audición a tonos altos, que se presenta a dosis mayores de 80 mg/L, y nefrotoxicidad (aumenta asociada a aminoglicósidos).
Teicoplanina a diferencia de vancomicina es más lipofílico, por lo que tiene mayor penetración intracelular, siendo su vida media más larga (40 - 70 hrs.), tiene alta unión proteica y lento aclaramiento renal, existiendo presentación intra-muscular con adecuada penetración tisular en general.
Efectos adversos renales y hombre rojo se describen también pero en menor frecuencia que con Vancomicina
LINEZOLID Es una nueva clase de antimicrobianos sintéticos: oxazolidinonas que actúan al inhibir de síntesis de proteínas a nivel de 50S, teniendo como gran ventaja una biodisponibilidad oral cercana al 100%, teniendo un espectro de acción contra bacterias Gram positivas y dentro de ellas de S. aureus resistente a meticilina (MRSA) y GISA.
Dentro de sus propiedades farmacológicas, tenemos una biodisponibilidad cercana a 100% (pico 1-2h) con una baja fijación a proteínas, siendo eliminada en un 30-35% por orina sin modificación, teniendo una vida media de eliminación de 5-7 horas.
Los efectos adversos descritos en los diferentes estudios clínicos en muchos de los cuales participó nuestro país figuran nauseas, diarrea y cefalea (2%), incremento leve en transaminasas, amilasa y lipasa, toxicidad hematológica como trombocitopenia y coloración oscura de la lengua.
Linezolid es seguro y bien tolerado en adultos a dosis de 600 mg. BID por hasta 28 días
ESTREPTOGRAMINAS: Este nuevo grupo de antibióticos es derivado del Streptomyces pristinaspiralis (pristinamicin, virginamicin, synercid), los cuales son de acción bactericida al inhibir la función ribosomal 50S siendo los usos clínicos aprobados para FDA: Infecciones de piel y partes blandas, infecciones por gram positivos resistentes y dentro de ellos se encuentra MRSA.
EVERNINOMICINA: Estos antibióticos oligosacaridos en fase de evaluación II y III (Avilamycin, evernimicin) se presentan en preparados parenterales, describiéndose actividad in vitro contra S. aureus Meticilina resistente, existiendo al momento limitada información sobre eficacia: infecciones de piel, respiratorias.
Control de la resistencia a los antibióticos
En la práctica clínica la aparición de bacterias resistentes a los antibióticos se ha relacionado con el excesivo uso de determinados antibióticos y el decremento en el uso de otros, a pesar de que la relación de causalidad no se puede definir completamente. El genoma bacteriano contiene complejas cadenas de genes que codifican la resistencia para uno o más antibióticos. Así, el uso de un antibiótico puede seleccionar la aparición de resistencia a otro. Aunque la aparición de resistencia a los antibióticos es inevitable, el uso racional de estos fármacos puede disminuir la velocidad a la que se desarrolla.
El estudio de la genética de la resistencia a los antibióticos, en particular el conocimiento de la gran transmisibilidad de plásmidos y transposones entre bacterias lleva a concluir que cada antibiótico tiene la capacidad de alterar de manera inexorable su micro ambiente y crear ventajas selectivas para microorganismos resistentes.
REFERENCIAS BIBLIOGRAFICAS
1. Burke A. Antibiotic Resistance, Medical Clinic of North America 84(6) 2000.
2. Turnidge J, Chang FY, Fowler VG. Staphylococcus aureus: Antimicrobial Therapy and Vaccines 2002Second Edition 631-58.
3. Fernández F, Lopez J, ponce LM, Machado C. Resistencia Bacteriana: Rev. Cubana Med. Milit. 2003;32(1): 44-8.
4. Jacoby GA, Archer GL. New mechanism of bacterial resistance to antimicrobial agents. N. Engl. J. Med. N Engl J Med. 1991 Feb 28;324(9):601-12.
5. Sanders CC, Sanders WE Jr. beta-Lactam resistance in gram-negative bacteria: global trends and clinical impact Clin Infect Dis. 1992 Nov;15(5):824-39.
6. Tan TQ. Antibiotic resistant infections due to Streptococcus pneumoniae: impact on therapeutic options and clinical outcome Curr Opin Infect Dis. 2003;16(3):271-7.
7. Ayliffe GAJ. The progressive Intercontinental Spread of methicillin-resistant Staphylococcus aureus . Clin Infect Dis 1997; 24: S74-S79.
8. Kaye KS, Fraimow HS, Abrutyn E. Pathogens Resistant to Antimicrobial Agents. Inf Dis Clin NA 2000; 2: 293-319.
9. Neu HC. The crisis in antibiotic resistance; Science. 1992 ;257(5073):1064-73.
10. Levy SB. The challenge of antibiotic resistance. Sci Am. 1998;278(3):46-53.
11. Mandell. Principles And Practice on Infectious Diseases. Fifth Edition 2000.
12. Lyon BR & Skurray R. Antimicrobial resistance of Sthaphylococcus aureus: Genetic basis. Microbiological reviews 1987; 51: 88-134.
13. Boyce JM. Methicillin resistan Staphylococcus aureus. Infect Dis Clin North Am 1989;3:901-13.
14. Lowy FD. Staphylococcus aureus Infections.NEJM 1998; 339:520-532.
15. Brumfitt W, Hamilton-Miller J. Methicillin-resistant Staphylococcus aureus NEJM 1989; 320:1188-1196.
16. Montanari MP, Tonin E, et al. Further characterization of borderline methicillin resistant Staphylococcus aureus and anallisis of penicillin binding proteins. Antimicrob Agents Chemoter, 1990;34:911–913.
17. Cosgrove SE, Sakoulas G, Perencevich EN, Schwaber MJ, Karchmer AW, Carmeli Y. Comparison of Mortality Associated with Methicillin-Resistant and Methicillin-Susceptible Staphylococcus aureus Bacteremia: A Meta-analysis. Clinical Infectious Diseases 2003;36:53-59.
18. Melzer M, Eykyn SJ, Gransden WR,Chinn S. Is Methicillin-Resistant Staphylococcus aureus More virulent than Methicillin-Susceptible S. aureus? A comparative cohort Study of British Patients with Nosocomial Infection and bacteremia . CID 2003; 37: 1453-60.
19. Weistein RA. Nosocomial Infection Update. Emerg Infect Dis. 1998 July-Sept;4:1-5.
20. Rubin RJ, Harrington CA, Poon A, Dietrich K, Greene JA, Moiduddin A. The economic impact of Staphylococcus aureus infection in New York City hospitals. Emerg Infect Dis. 1999;5: 9-17.
21. Abramson MA, Sexton DJ. Nosocomial methicillin-resistant and methicillin susceptible Staphylococcus aureus primary bacteremia: At Wath Cost. Infection Control and Hospital Epidemiology 199; 20: 408-11.
22. Echevarria JE, Ore L, Zerpa R, Campana C, Quispe V, Tamariz J, Prada A, Guerra H, Casas J. Prevalence of Methicillin Resitant Staphylococcus strains, in Hospitalized patients and susceptibility to Teicoplanin in Lima Peru. 20th International Congress of Chemotherapy. Sidney- Australia. Junio 1997. International Society of Chemotherapy. Libro de Resúmenes.
23. Cornejo M, Azpilcueta, et al. Staphylococcus aureus resistente a oxacilina en el servicio de medicina interna del HNSA. Boletín de la Sociedad Peruana de Enfermedades Infecciosas y Tropicales-SPEIT. 1995;4(2):66.
24. Sánchez L, Carrillo L, et al. Resistencia antibiótica de Estafilococos en el Hospital Arzobispo Loayza en Lima. Boletín de la Sociedad Peruana de Enfermedades Infecciosas y Tropicales-SPEIT. 1997;7:09-11.
25. Guerra J, Sánchez I, et al. Staphylococcus aureus resistente a oxacilina en el Hospital Carrión. Boletín de la Sociedad Peruana de Enfermedades Infecciosas y Tropicales-SPEIT. 1997;6(2):40.
26. Siguas A, Salazar N, et al. Susceptibilidad del Staphylococcus en un servicio de medicina. Boletín de la Sociedad Peruana de Enfermedades Infecciosas y Tropicales-SPEIT. 1997;6(2):41.
27. Gil A, Gaspar M, Sánchez P, Coello R, Fereres J. Personal sanitario como fuente de infección de un brote nosocomial de Staphylococcus aureus resistente a meticilina. Enferm Infec Microbiol Clin 1997;15:173-4.
28. Reagan DR, Doebbeling BN, Pfaller MA, Sheetz CT, Houston AK, Hollis RJ, Wenzel RP. Elimination of coincident Staphylococcus aureus nasal and hand carriage with intranasal application of mupirocin calcium ointment. Ann Intern Med 1991; 114:101-6.
29. Assadian O, Daxboeck F, Aspoeck C, Blacky A, Dunkl R, Koller W. National Survillance of Methicillin-sensitive and Methicillin-Resistant Staphylococcus aureus in Austrian Hospitals: 1994-1998. Journal of Hospital Infections 2003; 55: 175-79.
30. Chambers HF. The Changing Epidemiology of Staphylococcus aureus. Emerg Infect Dis. 2001;7 : 178-182.
31. Shopsin B, Mathema B, Martinez J, et al . Prevalence of methicillin-resistant and methicillin-susceptible Staphylococcus aureus in the community. J. Infect Dis. 2000;182(1):359-62.
32. Salgado CD, Farr BM, Calfee DP. Community-acquired methicillin-resistant Staphylococcus aureus: a meta-analysis of prevalence and risk factors. Clin Infect Dis. 2003;36(2):131-9.
33. Salmenlenna S, Lyytikainen O and Vuopio-Varkila. Community-acquired methicillin-resistant Staphylococcus aureus, Finland. Emerg Infect Dis. 2002; 8: 602-7.
34. Chambers HF. Methicillin resistance in staphylococci: molecular and biochemical basis and clinical implications. Clin Microbiol Rev. 1997 Oct;10(4):781-91. Review.
35. Naimi TS , LeDell KH, Como-Sabetti K, et al. Comparison of Community and Health Care Associated Methicillin Resistant Staphylococcus aureus Infections. JAMA, 2003; 290: 2976 - 2984.
36. Papia G, Louie M, Tralla A, Johnson C, Collins V, Simor AE. Screening high-risk patients for methicillin-resistant Staphylococcus aureus on admission to the hospital: is it cost effective? Infect Control Hosp Epidemiol. 1999 Jul;20(7):473-7.
37. Smith TL, Pearson ML, Wilcox KR, Cruz C, Lancaster MV, et al. Emergence of Vancomycin resistance in Staphylococcus aureus NEJM 1999 7 493-501.
38. Waldvogel FA. New Resistance in Staphylococcus aureus. NEJM 1999; 340:555-57.
39. Charles PG, Ward PB, Johnson PD, Howden BP, Grayson ML. Clinical features associated with bacteremia due to heterogeneous vancomycin-intermediate Staphylococcus aureus Clin Infect Dis 2004;38(3):448-51.
40. Hiramatsu K, Hanaki H, Ino T, et al. Methicillin-resistant Staphylococcus aureus clinical strain with reduced vancomycin susceptibility. J Antimicr. Chemoter 1997;40:135-6.
41. Tenover FC, Biddle JW and Lancaster MV. Increasing resistance to vancomycin and other glycopeptides in Staphylococcus aureus. Emerg Infect Dis. 2001; 7: 327-32.
42. Gutman M. Methicillin-resistant S.aureus and vancomicin-resistant enterococci: therapeutic r ealities and possibilities. Lancet 1997;349:1901-06.
43. Powers JH. Development of drugs for antimicrobial-resistant pathogens Curr Opin Infect Dis 2003;16(6):547-51.